近日,我院张满杰教授团队开发了一种智能响应的多功能纳米平台,放大了铜死亡与化学动力学疗法之间的协同作用机制,同时保留了化疗的基础,最终实现了显著的抗肿瘤效果。研究成果在《mesoporous nanoplatform that efficiently delivers dox as an h2o2 generator to trigger mutual amplification of cuproptosis and chemodynamic therapy》国际知名期刊《advanced healthcare materials》(if=9.6)发表。
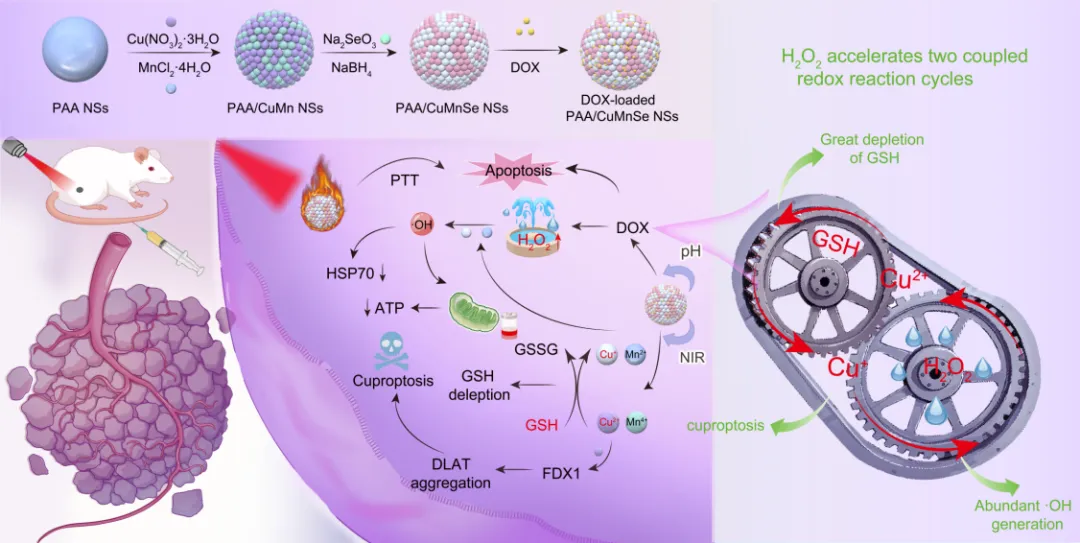
新兴的铜死亡疗法与化学动力学疗法(cdt)为抗肿瘤治疗带来新希望,有望克服传统化疗的耐药问题。铜死亡是因细胞内铜离子过量蓄积引发的程序性死亡,过量 cu⟡⁺干扰线粒体三羧酸循环,导致蛋白质异常聚集及铁硫簇蛋白丢失,进而诱发细胞死亡,同时铜参与氧化还原反应产生活性氧(ros)。cdt 则利用 fe、mn、cu 等金属离子与过氧化氢通过类芬顿反应生成高毒性羟基自由基杀伤肿瘤细胞。但二者均受限于 ros 相关问题:肿瘤细胞高谷胱甘肽会削弱铜死亡效果;肿瘤微环境内源性过氧化氢不足则限制 cdt 疗效。
针对当前肿瘤治疗中单一疗法效果有限的挑战,团队致力于开发多模式协同策略,课题组开发了聚丙烯酸/铜锰硒(paa/cumnse)纳米粒子实现了对化疗药物阿霉素(dox)的高效负载(载药量为49%),实现“三管齐下”。该载体高效递送化疗药阿霉素(dox)至肿瘤微环境(tme),并利用dox在肿瘤内原位产生的(h₂o₂)驱动“三管齐下”的协同治疗机制。纳米粒中的铜/锰离子通过耦合的氧化还原循环,协同驱动“铜死亡”(加速关键蛋白dlat聚集),提高类芬顿效应增强cdt,并叠加dox自身的化疗效果。体外和体内实验证明,通过化疗-铜死亡-cdt三重协同策略能够显著提升抗肿瘤效果。
我院张满杰教授为本文的通讯作者,我院研究生杜昊洋、佟宛泽、彭博为共同第一作者。
原文链接:https://doi.org/10.1002/adhm.202500933